О наборе "Волшебный светофор"
Волшебный светофор – это набор из шести красочных качественных реакций, которые не только помогут весело провести время, но и познакомят Вас с осно-вами химии!
 Итак, что же такое качественная реакция? Это такая реакция, с помощью которой мож-но определить наличие в растворе определённых веществ. Результатом такой реакции яв-ляется ощутимый эффект: появление или исчезновение окрашивания, выпадение или рас-творение осадка, выделение пузырьков газа и тому подобное.
Итак, что же такое качественная реакция? Это такая реакция, с помощью которой мож-но определить наличие в растворе определённых веществ. Результатом такой реакции яв-ляется ощутимый эффект: появление или исчезновение окрашивания, выпадение или рас-творение осадка, выделение пузырьков газа и тому подобное.Несколько слов о растворении веществ. Раствор – это однородная смесь, состоящая из частиц растворённого вещества, растворителя (в большинстве случаев это вода) и продуктов их взаимодействия. Некоторые вещества хорошо растворяются в воде, например, сахар, хлорид натрия (пищевая соль), гидроксид натрия. Другие – почти не растворяются, например, карбонат кальция (мрамор), фосфат кальция (основной строи-тельный материал костей и зубов).
Растворение веществ часто происходит с изменением температуры раствора: рас-творение глюкозы в воде происходит с небольшим понижение температуры, а растворе-ние гидроксида натрия – с заметным её повышением.
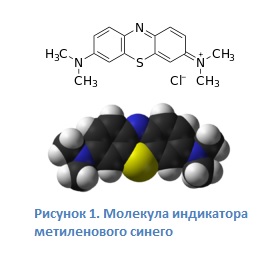 Окисление глюкозы
Окисление глюкозы
При встряхивании колбы идёт обратная реакция – окисление. Бесцветная форма индикатора окисляется кислородом, содержащимся в воздухе в колбе, обратно до синего цвета. Глюкоза же необратимо расходуется в процессе реакции, окисляясь до глю-коновой кислоты. И когда она вся окислится, реакция прекратится.
Химические превращения, которые происходят в процессе данной реакции, явля-ются частично обратимыми, то есть, переход цвета «синий–бесцветный–синий» можно наблюдать в течение про-должительного времени, которое зависит от температуры раствора (влияет на скорость перехода цветов) и его изначальной концентрации (влияет на продолжительность перехо-дов).
 Волшебный светофор
Волшебный светофор
 Искусственная кровь
Искусственная кровь
Скажите своим зрителям, что вы смачиваете ватку «спиртом» и смажьте им место будущего пореза. Разумеется, вместо спирта вы возьмёте раствор рода-нида калия. Теперь возьмите нож, для пущей дезинфекции смочите его края «йодом», роль которого сыграет раствор хлорида железа. Попросите добро-вольца повернуть место будущего пореза к зрителям и медленно проведите по нему но-жом. Можно несколько раз. На глазах у изумлённой аудитории в месте «пореза» выступит тёмно-красная «кровь». После смочите ват-ный диск в «живой воде» – растворе фторида аммония и «исцелите» порез.
Внимание! Сразу после проведения этого эксперимента обязательно тщательно промойте руку водой!
 Универсальная индика-торная бумага
Универсальная индика-торная бумага
Кислотность – это сложное химическое понятие, показывающее степень со-держания ионов водорода в каком-либо растворе. Ион – заряженная отрица-тельно или положительно составная часть вещества. Откуда же берутся ионы водоро-да?
Молекулы воды способны распадаться (диссоциировать) на две заряженные части-цы, которые называются ионами (от древне-греческого ??ν – идущее). Диссо-циация обратима, то есть ионы H+ и OH– могут снова об-разовать молекулу воды:
H2O ↔ H+ + OH–
Так же как и вода, многие другие вещества тоже распадаются на ионы при растворении. Например, соляная кислота HCl в водном растворе диссоциирует на ионы H+ и Cl–, то есть общее количество ионов H+ в растворе увеличится. И напротив, добавление сильной щёлочи, например, гидроксида натрия NaOH (диссоциирующей на ионы Na+ и OH–) увеличит содержание ионов OH– в растворе.
Для удобства и наглядности содержание ионов H+ и OH– выражают в виде водородного показателя pH и гидроксильного показателя pOH. В быту чаще всего используется водородный показатель или «кислотность». Её выражают значением рН, причём если рН равен 7, то го-ворят, что среда «нейтральна», если рН меньше 7, то среда «кислая», а если рН больше 7, то среда «щелочная».
При определении кислотности предложенных растворов кислоты и щёлочи очень важно использовать разные концы стеклянной палочки, чтобы растворы не смешивались. Это приведёт к протеканию реакции нейтрализации и, как следствие, неточному результа-ту.
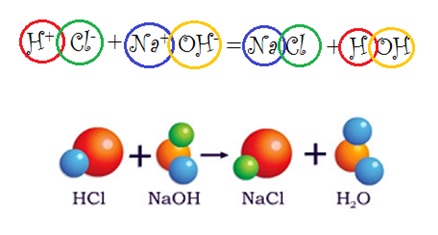 Реакция нейтрализации
Реакция нейтрализации
Соляная кислота представлена в виде 9%-ного водного раствора. Как мы уже зна-ем, она может распадаться на ионы H+ и Cl–. Гидроксид натрия NaOH в растворе тоже диссоциирует на ионы Na+ и OH. Если их сме-шать, то кислота и щёлочь будут взаимно обмениваться ионами.
В результате этого обмена образуется хлорид натрия NaCl и вода H2O. И если кислоты и щёлочи было одинаковое количество, то получившийся раствор будет нейтральным.
Чаще всего в результате протекания реакций нейтрализации выделяется теплота. Тем не менее, существуют реакции нейтрализации, которые сопровождаются поглощени-ем тепла и понижением температуры раствора, например, взаимодействие пищевой соды и уксусной кислоты.
Индикатор фенолфталеин бесцветен в кислой среде, однако резко меняет свою ок-раску в щёлочи. Для запоминания цвета фенолфталеина в различных средах есть мнемо-ническое правило:
Фенолфталеиновый — в щелочах малиновый
Но, несмотря на это, в кислотах он без цвета.
Но, несмотря на это, в кислотах он без цвета.
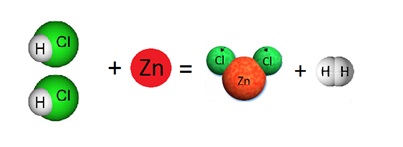 Водородные пузыри
Водородные пузыри
2·HCl + Zn = ZnCl2 + H2↑
Купить набор химических опытов "Волшебный светофор"

Сеть магазинов развивающих игр SKILL
Добро пожаловать в интернет-магазин развивающих игрушек "Skill"
В ассортименте нашего магазина Вы найдёте интеллектуальные и развивающие игры, которые будут интересны не только для мальчиков и девочек разных возрастов, но и не дадут заскучать взрослым!
Магазин с гордостью представляет Вам собственную линию наборов для проведения химических опытов в домашних условиях SKILL. Наши наборы включают в себя высококачественные реагенты, настоящую лабораторную посуду, все необходимые средства защиты и инструкции. С ними Вы можете быть уверены не только в увлекательности и познавательности проводимых опытов, но и в их безопасности!
У нас Вы также можете найти конструкторы на любой вкус: металлические конструкторы Meccano; конструкторы с питанием от природных источников Gigo; наборы для создания роботов и устройств, работающих на природной энергии 4M.
В нашем магазине Вы найдете идеи подарков для широчайшей аудитории! Игры, развивающие память и мелкую моторику, тренирующие мышление, терпение и усидчивость, помогающие постичь окружающий мир — всё это и многое другое Вы можете купить онлайн и в наших магазинах в Санкт-Петербурге!
Играйте и развивайтесь со "Skill"!





