О наборе "Вулкан"
 С помощью этого набора можно провести два абсолютно разных эксперимента, в основе которых лежит один и тот же тип химических превращений – окислительно-восстановительная реакция.
С помощью этого набора можно провести два абсолютно разных эксперимента, в основе которых лежит один и тот же тип химических превращений – окислительно-восстановительная реакция.Окислительно-восстановительная реакция (сокращённо ОВР) – это химическое взаимодействие между веществами, при котором происходит обмен электронами и изменение степени окисления веществ. Вещество, отдающее электрон, называется восстановителем; вещество, присоединяющее электрон, называется окислителем. Понятие «степень окисления» в неорганической химии обычно подразумевает способность атома образовывать определённое число химических связей с помощью обмена электронами. Она указывается римскими цифрами в скобках.
Перед вами кристаллическое вещество ярко-оранжевого цвета – бихромат (или дихромат) аммония. Особенность этого вещества в том, что в нём содержится и окислитель, и восстановитель. Поэтому реакция (ОВР) может проходить «внутри» этой соли:

Реакция начинается от горящей спички (изопропанол нужен для более быстрого начала реакции), но не прекратилась, когда спичку убрали, а стала ещё интенсивнее. Дело в том, что в процессе реакции выделяется теплота, которая поддерживает дальнейшее протекание реакции и раскаляет образующиеся частицы оксида хрома, которые вылетают вверх искрами, что особенно заметно при проведении эксперимента в затемнённом помещении. Процесс термического разложения бихромата аммония развивается лавинообразно до тех пор, пока весь кристаллический бихромат аммония не превратится в рыхлый зелёный оксид хрома (III), азот и воду.

История открытия данной реакции начинается в XIX веке. В 1843 г. Немецкий химик Рудольф Бёттгер, прославившийся изобретением современных спичек и взрывчатого вещества пироксилина, получил дихромат аммония (NH4)2Cr2O7 – оранжево-красное кристаллическое вещество. Как обычно, он решил испытать это вещество на способность взрываться от удара и воспламеняться от горящей лучины. Удар молотом на чугунной плите всего лишь превратил кристаллы дихромата аммония в порошок. Затем, насыпав на тарелку горку кристаллов, Бёттгер поднес к ней горящую лучинку. Кристаллы не вспыхнули, но вокруг конца горящей лучинки что-то «закипело», начали стремительно вылетать раскаленные частицы. Горка стала увеличиваться и скоро приняла внушительные размеры. Изменился и ее цвет: вместо оранжевого он стал зелёным. Впоследствии эта реакция была названа по имени её первооткрывателя – вулкан Бёттгера.
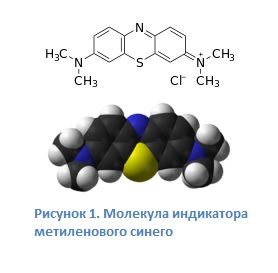 Бонус! Окисление глюкозы
Бонус! Окисление глюкозы
При встряхивании колбы идёт обратная реакция – окисление. Бесцветная форма индикатора окисляется кислородом, содержащимся в воздухе в колбе, обратно до синего цвета. Глюкоза же необратимо расходуется в процессе реакции, окисляясь до глюконовой кислоты. И когда она вся окислится, реакция прекратится.
Химические превращения, которые происходят в процессе данной реакции, являются частично обратимыми, то есть, переход цвета «синий–бесцветный–синий» можно наблюдать в течение продолжительного времени, которое зависит от температуры раствора (влияет на скорость перехода цветов) и его изначальной концентрации (влияет на продолжительность переходов).
Купить набор химических опытов "Вулкан"

Сеть магазинов развивающих игр SKILL
Добро пожаловать в интернет-магазин развивающих игрушек "Skill"
В ассортименте нашего магазина Вы найдёте интеллектуальные и развивающие игры, которые будут интересны не только для мальчиков и девочек разных возрастов, но и не дадут заскучать взрослым!
Магазин с гордостью представляет Вам собственную линию наборов для проведения химических опытов в домашних условиях SKILL. Наши наборы включают в себя высококачественные реагенты, настоящую лабораторную посуду, все необходимые средства защиты и инструкции. С ними Вы можете быть уверены не только в увлекательности и познавательности проводимых опытов, но и в их безопасности!
У нас Вы также можете найти конструкторы на любой вкус: металлические конструкторы Meccano; конструкторы с питанием от природных источников Gigo; наборы для создания роботов и устройств, работающих на природной энергии 4M.
В нашем магазине Вы найдете идеи подарков для широчайшей аудитории! Игры, развивающие память и мелкую моторику, тренирующие мышление, терпение и усидчивость, помогающие постичь окружающий мир — всё это и многое другое Вы можете купить онлайн и в наших магазинах в Санкт-Петербурге!
Играйте и развивайтесь со "Skill"!





